先月、2017年度のノーベル生理学・医学賞が発表されました。
今年の同賞は、概日リズム(Circadian rhythms;サーカディアン・リズム)を生み出す遺伝子とそのメカニズムを発見した米ブランダイス大学のホール(Jeffrey C. Hall)博士とロスバシュ(Michael Rosbash)博士,ロックフェラー大学のヤング(Michael W. Young)博士の3氏に授与されました。
Nobel prize for medicine awarded for insights into internal biological clock
3氏のお祝いに、今回は藻類の概日リズムについて紹介します。
動物の概日リズムと生物時計
まず、概日リズムの解明が、ノーベル生理学・医学賞に値する成果である理由をお話しします。
そもそも、概日リズムとは、恒常環境下でその存在が確かめられる、約24時間周期で変動する生理現象です。この3氏は、ショウジョウバエを使って、「概日リズムが、per(period)遺伝子とtim(timeless)遺伝子の転写制御と、この2つの遺伝子が作り出すタンパク質発現量により、自律的に作られる時間制御機構である」ことを明らかにしました。これは、タンパク質量が「振子」の役割をしていて、ほぼ24時間を刻む自律的な「振動」の仕組みを生物の細胞が内在的に持っているということです。per遺伝子とtim遺伝子を「時計遺伝子」と呼ぶこともあります。
概日リズムと似た言葉に、「体内時計」、「生物時計」という言葉があります。どちらも、biological clockの和訳で同義です。生物時計とは、自律的に動く概日リズムが基本となって、光や温度、食事など外部刺激によって補正・同調される、生物が生まれつき備わっている時間測定機構です。生物時計が働くことで、生物は環境変化に応じて生活ができるのです。
3氏の概日リズムの解明により、生物時計の研究が急速に発展していき、「時間生物学」という学問分野が確立しました。そして、その発展の一つが、医学分野です。実は哺乳類にも、ショウジョウバエで解明された概日リズムのメカニズムとほぼ同じものを有しています。生物時計は睡眠パターン、摂食行動、ホルモン放出、血圧、体温調節などに必要なシステムであることがわかってきました。また、細胞が無限に増殖してしまうガン細胞も、生物時計の異常と考えられていて、生物時計のメカニズムに基づいた新薬の開発が進められています。
生物時計の仕組み
ここで、ショウジョウバエの生物時計を説明します。
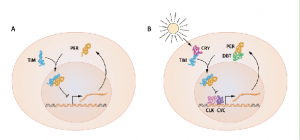
上図のAは、ショウジョウバエで解明された、概日リズムです。
細胞核でDNA上にあるper遺伝子から、mRNAに転写されて、細胞質に移動してPERタンパク質に翻訳されます。PERタンパク質は細胞質でTIMタンパク質と結合して細胞核に戻り、per遺伝子の転写を抑制します。PERタンパク質は一定時間後には分解していくため、TIMタンパクとの結合が外れて、抑制されていたper遺伝子は再び転写を開始します。このように、概日リズムは自身のタンパク質による転写や翻訳を抑制的に「フィードバック*」するメカニズムなのです。
*Transcription/Translation Feedback Loopともいいます
PERタンパク質、TIMタンパク質のフィードバックが明らかにされてから、概日リズムの更なる詳細が解明されています。また、 外部刺激に対する生物時計の制御機構もわかってきました。これが上図のBです。
概日リズムとしては、per遺伝子の転写を活性化するタンパク質因子(CLY、CYC)、PERタンパク質の分解を促すタンパク質因子(DBT)等の働きにより、生物は「24時間」という時の長さをより正確に測っていることがわかりました。
生物時計の補正機構において、最も研究されているのは「光」です。光刺激に対して生成されるタンパク質因子(CRY)は、TIMタンパク質の分解を促すことでPERタンパク質との結合体が形成されなくなります。このことによりper遺伝子の転写抑制ができなくなり、per遺伝子の転写、翻訳が進行して、フィードバック機構がリセットされます。
様々な生物の概日リズム
地球上で生きていくうえで、24時間周期の環境変化はどの生物も対応していかなければなりません。概日リズムは、おそらく生物共通でもっているはずです。藻類も含めて、ショウジョウバエ以外の生物はどうなっているのでしょうか?
以前、下記記事にて、生物は元を辿ると一つの生命から誕生したと紹介しました。
生命はちょっとずつ変化をしながら違う生物種に進化しているため、生命の生存に関わる機能(タンパク質合成機構や細胞分裂機構等)に関わる遺伝子は、基本的に生物共通であり、相同性があります。
概日リズムもまた、生きていくうえで重要な仕組みです。そのため、時計遺伝子も相同性があるかと思いきや、様々な生物種で概日リズムの分子メカニズムが発見されてくる中、生物分類群による時計遺伝子には相同性がないことが分かってきました。つまり、生物分類群によって時計遺伝子は独立に生まれてきたと考えられます。一方で、面白いことに、生物分類群間で時計遺伝子に相同性がないにもかかわらず、概日リズムメカニズムは、どの生物も遺伝子転写量と遺伝子発現量が制御する「フィードバック」によって細胞内で自律的に振動している、という共通のメカニズムがわかったのです。
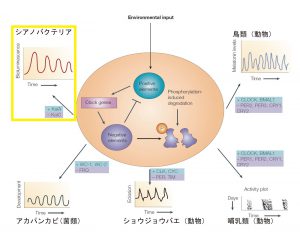
上図は、生物の概日リズムのイメージと、シアノバクテリアと動物界(アカパンカビ、ショウジョウバエ、哺乳類、鳥類)における主な時計遺伝子を示しています。
概日リズムの共通メカニズムは、「促進タンパク質(Positive elements)」、「抑制タンパク質(Negative elements)」、「抑制タンパク質の分解(degradation)」、そして「抑制タンパク質をコードする時計遺伝子(Clock genes)」が関わっています。「抑制タンパク質をコードする時計遺伝子」は、「促進タンパク質」の活性化によって転写、翻訳され、「抑制タンパク質」が生成されます。「抑制タンパク質」は促進タンパク質の活性を抑えるため、「抑制タンパク質」が存在しているときには、「抑制タンパク質をコードする時計遺伝子」は転写されません。しかし、「抑制タンパク質」はリン酸化(Phosphorylation)により一定時間後に「抑制タンパク質の分解」が進められるため、「促進タンパク質」の活性が戻り、「抑制タンパク質をコードする時計遺伝子」は転写されます。
ショウジョウバエ(オピストコンタ、動物界節足動物門昆虫綱)の時計遺伝子を例にすると、促進タンパク質をコードする遺伝子はCLK・CYC、抑制タンパク質をコードする遺伝子はPER・TIMとなります。他の動物の時計遺伝子を見てみると、哺乳類(オピストコンタ、動物界脊椎動物門哺乳綱)、鳥類(オピストコンタ、動物界脊椎動物門鳥綱)はショウジョウバエと一部が同じで、一部が異なります。アカパンカビ(オピストコンタ、菌界子嚢菌門フンタマカビ綱)はショウジョウバエとは全く違います。
以前の筆者の記事で、全生物の系統樹を示し、動物界と菌界は同じ「オピストコンタ」のスーパーグループに属することをお話ししました。他のスーパーグループ6つのうち、5つに藻類が点在しています。
こちら、詳細は『藻類とは? -実は曖昧な藻類の定義。その理由に迫る-』にも記載しております。
同じ「オピストコンタ」でも異なる生物群によって時計遺伝子が存在しているのですから、藻類の時計遺伝子も、藻類群によって異なる遺伝子を持つことが予想されます。
藻類の概日リズム
藻類の概日リズムによる現象はいくつか知られています。例えば、渦鞭毛藻類Gonyaulaxの発光現象(Roenneberg&Morse 1993)、ユーグレナ藻類の走行性リズム(Feldman 1967)などが挙げられます。また、多くの藻類で細胞分裂が明暗同調により起こることが知られています。しかし、藻類で生物概日リズムが分子レベルでわかっているものは多くありません。
藻類の概日リズムで一番研究が進んでいるのは、シアノバクテリア(藍藻)です(Iwaki&Kondo 2004)。原核生物のシアノバクテリア(真正細菌、シアノバクテリア)の概日リズムも、生物共通の「フィードバック」機構になっています。上図の通り、促進タンパク質をコードする遺伝子はKaiA、抑制タンパク質をコードする遺伝子はKaiCです。シアノバクテリアの概日リズムは他にわかっている生物群の概日リズムよりも単純であり、試験管レベルでの概日リズムが再現できています(Nakajima et al. 2005)。
次に進んでいるのは、クラミドモナス(プランテ、緑色植物門緑藻綱)です(Matsuo et al. 2011)。クラミドモナスの葉緑体は、原核生物シアノバクテリアを細胞内共生させた細胞小器官です。
詳しくは下記記事をご覧ください。
細胞内共生では、シアノバクテリアの遺伝子ごと取り込んだと考えられています。しかし、クラミドモナスの概日リズムに葉緑体(シアノバクテリア)由来のKaiA、KaiC遺伝子は関係なく、細胞核の遺伝子によって制御されていました。緑藻の時計遺伝子はROC(Rhythm Of Chloroplast)遺伝子群と名付けられています。クラミドモナスの概日リズムのフィードバック機能はまだ研究途中ですが、時計遺伝子が既知で、緑藻から進化した高等植物シロイズナズナ(プランテ、緑色植物門アブラナ科)と相同性のある遺伝子が見つかっています。ここから、クラミドモナスの時計遺伝子は、促進タンパク質をコードする遺伝子ROC40、抑制タンパク質をコードする遺伝子ROC15、75と推測されます。
藻類の分子メカニズム解明の難しさ
1970年代、ショウジョウバエの概日リズム遺伝子の変異体が分離されました。その正体がper遺伝子だったのです。実は、クラミドモナスでも、同時期に概日リズム遺伝子の変異体が分離されていました。当時、ショウジョウバエをはじめ、アカパンカビ、マウス、シロイズナズナなどで次々と時計遺伝子が明らかになる中で・・・クラミドモナスの時計遺伝子は未だに特定できていません。
複数のスーパーグループにまたがる藻類は、研究が進めやすいモデル生物も少なく、概日リズムや時計遺伝子といった様々な現象の分子レベルメカニズムの解明には時間がかかると思います。果たして、その日が来るのかもわからない状態です。
しかし、わからないからこそ、地道に真正面から藻類と向き合い、藻類の声に耳を傾け、藻類とともに歩んでいきたい。これが私のちとせ研究所でのモットーです。
参考文献
・Institutet, Nobelförsamlingen Karolinska. “Advanced Information: The 2017 Nobel Prize in Physiology or Medicine.” (2017).
・Bell-Pedersen, Deborah, et al. “Circadian rhythms from multiple oscillators: lessons from diverse organisms.” Nature Reviews Genetics 6.7 (2005): 544-556.
・Wijnen, Herman, and Michael W. Young. “Interplay of circadian clocks and metabolic rhythms.” Annu. Rev. Genet. 40 (2006): 409-448.
・Roenneberg, Till, and David Morse. “Two circadian oscillators in one cell.” Nature 362.6418 (1993): 362-364.
・Feldman, Jerry F. “Lengthening the period of a biological clock in Euglena by cycloheximide, an inhibitor of protein synthesis.” Proceedings of the National Academy of Sciences 57.4 (1967): 1080-1087.
・Iwasaki, Hideo, and Takao Kondo. “Circadian timing mechanism in the prokaryotic clock system of cyanobacteria.” Journal of biological rhythms 19.5 (2004): 436-444.
・Nakajima, Masato, et al. “Reconstitution of circadian oscillation of cyanobacterial KaiC phosphorylation in vitro.” Science 308.5720 (2005): 414-415.
・Matsuo, Takuya, and Masahiro Ishiura. “Chlamydomonas reinhardtii as a new model system for studying the molecular basis of the circadian clock.” FEBS letters 585.10 (2011): 1495-1502.
・松尾拓哉 “クラミドモナスの概日時計-ようやく始まった分子レベルの研究-” 時間生物学 19.1(2013): 26-33.











_e2-300x300.png)



SHARE